SE REALIZO UN QUIZ DE NOMENCLATURA ORGANICA.
Y SE REALIZARON EJERCICIOS DEL DOCUMENTO.
Definición de Cetonas y Aldehídos
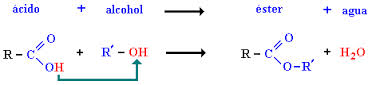
Los aldehídos y las cetonas son funciones en segundo grado de oxidación. Se consideran derivados de un hidrocarburo por sustitución de dos átomos de hidrógeno en un mismo carbono por uno de oxígeno, dando lugar a un grupo oxo (=O). Si la sustitución tiene lugar en un carbono primario, el compuesto resultante es un aldehído, y se nombra con la terminación -al. Si la sustitución tiene lugar en un carbono secundario, se trata de una cetona, y se nombra con el sufijo -ona.
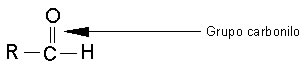
El grupo funcional conocido como grupo carbonilo, un átomo de carbono unido a un átomo de oxigeno por un doble enlace- se encuentra en compuestos llamados aldehídos y cetonas.
En los aldehídos. El grupo carbonilo se une a un átomo de hidrógeno y a un radical Alquilo, con excepción del formaldehído o metanol.
En las cetonas, el carbonilo está unido a dos radicales que pueden ser iguales, diferentes, alquílicos. La fórmula abreviada de una cetona es RCOR.
Los aldehídos y las cetonas son muy reactivos, pero los primeros suelen ser los más reactivos.
El grupo carbonilo se encuentra unido a dos radicales hidrocarbonados: si éstos son iguales, las cetonas se llaman simétricas, mientras que si son distintos se llaman asimétricas.
Según el tipo de radical hidrocarbonado unido al grupo funcional, Los aldehídos pueden ser: alifáticos, R-CHO, y aromáticos, Ar-CHO; mientras que las cetonas se clasifican en: alifáticas, R-CO-R', aromáticas, Ar-CO-Ar, y mixtas; R-CO-Ar, según que los dos radicales unidos al grupo carbonilo sean alifáticos, aromáticos o uno de cada clase, respectivamente.
Nomenclatura de Aldehídos y Cetonas
Para denominar los aldehídos y cetonas se puede usar el sistema IUPAC. En ambos casos primero se debe encontrar la cadena hidrocarbonada más larga que contenga al grupo carbonilo. La terminación -o de los hidrocarburos se reemplaza por -al para indicar un aldehído.
Las cetonas se denominan cambiando la terminación -o de la cadena carbonada lineal más larga que contienen al grupo carbonilo por la terminación -ona del carbonilo en la cadena carbonada.
Algunos aldehídos y cetonas comunes
| FÓRMULA CONDENSADA | NOMBRE SEGÚN IUPAC | NOMBRE COMÚN |
| Aldehído | | |
| HCHO | Metanal | Formaldehído |
| CH3CHO | Etanal | Acetaldehído |
| CH3CH2CHO | Propanal | Propionaldehído |
| CH3CH2CH2CHO | Butanal | Butiraldehído |
| C6H5CHO | Benzaldehído | Benzaldehído |
| Cetonas | | |
| CH3COCH3 | Propanona | Cetona (dimetilcetona) |
| CH3COC2CH5 | Butanona | Metiletilcetona |
| C6H5COC6H5 | Difenilmetanona/cetona | Benzofenona |
| C6H10O | Clicohexanona | Ciclohexanona |
Propiedades físicas
Las características especiales del grupo carbonilo influyen en las propiedades físicas de las cetonas y de los aldehídos.
Punto de ebullición: temperatura de ebullición mayor que hidrocarburos del mismo peso molecular, pero menor que el de los alcoholes y ácidos carboxílicos comparables. Esto se debe a la formación de dipolos y a la ausencia de formación de puentes de hidrógeno intramoleculares en éstos compuestos.
Los aldehídos y las cetonas no pueden formar enlaces intermoleculares de hidrógeno, porque al carecer de grupos hidroxilo (-OH) sus puntos de ebullición son más bajos que los alcoholes correspondientes. Sin embargo, los aldehídos y las cetonas pueden atraerse entre sí mediante las interacciones polar-polar de sus grupos carbonilo y sus puntos de ebullición son más altos que los de los alcanos correspondientes.
Con excepción del metanol, que es gaseoso a la temperatura ambiente, la mayor parte de los aldehídos y cetonas son líquidos y los términos superiores son sólidos. Los primeros términos de la serie de los aldehídos alifáticos tienen olor fuerte e irritante, pero los demás aldehídos y casi todas las cetonas presentan olor agradable por lo que se utilizan en perfumería y como agentes aromatizantes.
Solubilidad: a medida que aumenta el tamaño de las moléculas, disminuye la solubilidad de los compuestos. Los aldehídos y las cetonas pueden formar enlaces de hidrógeno con las moléculas polares del agua. Los primeros miembros de la serie (formaldehído, acetaldehído y acetona) son solubles en agua en todas las proporciones. A medida que aumenta la longitud de la cadena del hidrocarburo, la solubilidad en agua decrece. Cuando la cadena carbonada es superior a cinco o seis carbonos, la solubilidad de los aldehídos y de las cetonas es muy baja. Como era de suponer, todos los aldehídos y cetonas son solubles en solventes no polares.
Estado físico: bajo peso molecular (gases), peso molecular intermedio (líquidos) y compuesto pesados (sólidos).
Propiedades químicas
Las cetonas y los aldehídos se comportan como ácidos debido a la presencia del grupo carbonilo, esto hace que presenten reacciones típicas de adición nucleofílica.
- Reacciones de adición nucleofílica
- Reducción o hidrogenación catalítica
- Reacciones de sustitución halogenada
- Reacciones de condensación aldólica
- Reacciones de oxidación.
Aplicaciones de Aldehídos y Cetonas
Se ha aislado una gran variedad de aldehídos y cetonas a partir de plantas y animales; muchos de ellos, en particular los de peso molecular elevado, tienen olores fragantes o penetrantes. Por lo general, se les conoce por sus nombres comunes, que indican su fuente de origen o cierta propiedad característica. A veces los aldehídos aromáticos sirven como agentes saborizantes. El benzaldehído (también llamado "aceite de almendra amargas") es un componente de la almendra; es un líquido incoloro con agradable olor a almendra. El cinamaldehído da el olor característico a la esencia de canela. La vainilla que produce el popular sabor a